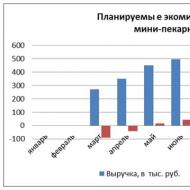
Elektroninė konfigūracija zn2. Sudėtinių junginių struktūra. Molekulinės orbitos teorija
Svarbiausias TCT pasiekimas yra geras sudėtingų junginių ypatingos spalvos priežasčių paaiškinimas. Prieš bandydami paaiškinti spalvos atsiradimo sudėtinguose junginiuose priežastį, prisiminkite, kad matoma šviesa yra elektromagnetinė spinduliuotė, kurios bangos ilgis yra nuo 400 iki 700 nm. Šios spinduliuotės energija yra atvirkščiai proporcinga jos bangos ilgiui:
E = h × n = h × c/l
Energija 162 193 206 214 244 278 300
E, kJ/mol
Bangos ilgis 760 620 580 560 490 430 400
Pasirodo, kad d lygmens skaidymosi kristalo lauku energija, žymima simboliu D, yra tokio paties dydžio kaip ir matomos šviesos fotono energija. Todėl pereinamųjų metalų kompleksai gali sugerti šviesą matomoje spektro srityje. Sugertas fotonas sužadina elektroną iš žemesnio d-orbitalių energijos lygio į aukštesnį lygį. Paaiškinkime tai naudodami 3+ pavyzdį. Titanas (III) turi tik 1 d-elektroną; kompleksas turi tik vieną absorbcijos smailę matomoje spektro srityje. Didžiausias intensyvumas 510 nm. Šio bangos ilgio šviesa priverčia d elektroną iš apatinio d orbitalių energijos lygio judėti į viršutinį. Dėl spinduliuotės sugerties absorbuotos medžiagos molekulė pereina iš pagrindinės būsenos su minimalia energija E 1 į didesnės energijos būseną E 2. Sužadinimo energija paskirstoma per atskirus molekulės virpesių energijos lygius, virsta šilumine energija. Elektroniniams perėjimams, kuriuos sukelia griežtai apibrėžtų šviesos energijos kvantų sugertis, būdingos griežtai apibrėžtos sugerties juostos. Be to, šviesos sugertis įvyksta tik tuo atveju, kai sugerto kvanto energija sutampa su energijos skirtumu DE tarp kvantinės energijos lygių galutinėje ir pradinėje sugeriančios molekulės būsenose:
DE = E 2 – E 1 = h × n = h × c/l,
kur h yra Planko konstanta; n – sugertos spinduliuotės dažnis; c – šviesos greitis; l yra sugertos šviesos bangos ilgis.
Kai medžiagos mėginys apšviečiamas šviesa, visų mėginio nesugertų spalvų atspindėti spinduliai patenka į mūsų akis. Jei mėginys sugeria visų bangų ilgių šviesą, spinduliai nuo jo neatsispindi, ir toks objektas mums atrodo juodas. Jei mėginys visiškai nesugeria šviesos, mes jį suvokiame kaip baltą arba bespalvį. Jei mėginys sugeria visus spindulius, išskyrus oranžinį, jis atrodo oranžinis. Galimas ir kitas variantas – mėginys gali pasirodyti oranžinis net tada, kai į mūsų akis patenka visų spalvų, išskyrus mėlyną, spinduliai. Ir atvirkščiai, jei mėginys sugeria tik oranžinius spindulius, jis atrodo mėlynas. Mėlyna ir oranžinė vadinamos papildomomis spalvomis.
Spektrinių spalvų seka: Į kas O medžiotojas ir nori h ne, G de Su eina f Adhanas - Į raudona, O diapazonas, ir geltona, hžalias , G mėlyna, Su mėlyna , f violetinė
Vandens kompleksui 3+ skaitinė D vertė skaičiuot. = 163 kJ/mol atitinka matomos raudonos spinduliuotės ribą, todėl vandeniniai Fe 3+ druskų tirpalai yra praktiškai bespalviai. Heksacianoferatas (III) turi D dist. = 418 kJ/mol, o tai atitinka sugertį mėlynai violetinėje spektro dalyje ir atspindį geltonai oranžinėje. Tirpalai, kuriuose yra heksacianoferato (III) jonų, yra geltoni su oranžiniu atspalviu. D vertė 3+ yra mažas, palyginti su 3-, o tai atspindi ne itin didelę Fe 3+ -OH 2 surišimo energiją. Didelė 3- skilimo energija rodo, kad Fe 3+ -CN jungimosi energija yra didesnė, todėl CN pašalinimui reikia daugiau energijos. Iš eksperimentinių duomenų žinoma, kad H 2 O molekulių 3+ koordinacinėje sferoje vidutinė gyvavimo trukmė yra apie 10 -2 s, o 3- kompleksas labai lėtai atskiria CN ligandus.
Pažvelkime į kelis pavyzdžius, kurie leidžia išspręsti problemas naudojant TCP.
Pavyzdys: trans-+ komplekso jonas sugeria šviesą daugiausia raudonojoje spektro srityje – 640 nm. Kokia šio komplekso spalva?
Sprendimas: kadangi aptariamas kompleksas sugeria raudoną šviesą, jo spalva turi būti žalia, papildanti raudoną.
Pavyzdys: jonai A1 3+, Zn 2+ ir Co 2+ yra ligandų oktaedrinėje aplinkoje. Kurie iš šių jonų gali sugerti matomą šviesą ir dėl to mums atrodyti spalvoti?
Sprendimas: A1 3+ jonas turi elektroninę konfigūraciją. Kadangi jis neturi išorinių d elektronų, jis nėra spalvotas. Zn 2+ jonas turi elektroninę konfigūraciją – 3d 10. Šiuo atveju visos d-orbitalės yra užpildytos elektronais. Orbitalės d x 2– y2 ir d x 2 negali priimti elektrono, sužadinto iš d xy , d yz , d xz orbitalių žemesnio energijos lygio. Todėl Zn 2+ kompleksas taip pat yra bespalvis. Co 2+ jonas turi elektroninę konfigūraciją – d 7. Tokiu atveju galima perkelti vieną d-elektroną iš d xy, d yz, d xz orbitalių apatinio energijos lygio į d x 2– y2 ir d x 2 orbitalių viršutinį energijos lygį. Todėl Co 2+ jonų kompleksas yra spalvotas.
Pavyzdys: kaip paaiškinti, kodėl diamagnetinių kompleksų 3+, 3+, 3– spalva yra oranžinė, o paramagnetinių kompleksų 3–, 0 – mėlyna?
Sprendimas: oranžinė kompleksų spalva rodo sugertį mėlynai violetinėje spektro dalyje, t.y. trumpojo bangos ilgio srityje. Taigi šių kompleksų padalijimas yra didelė vertė, užtikrinanti jų priklausymą žemo sukimosi kompleksams (D>P). Elektronų poravimas (d 6 konfigūracija, visi šeši elektronai t 2g polygyje) atsiranda dėl to, kad ligandai NH 3 , en, NO 2 - priklauso dešinei spektrocheminės serijos pusei. Todėl kompleksuodami jie sukuria stiprų lauką. Nuspalvinus antrąją kompleksų grupę mėlynai reiškia, kad jie sugeria geltonai raudoną energiją, t.y. ilgųjų bangų spektro dalis. Kadangi bangos ilgis, kuriame kompleksas sugeria šviesą, lemia skilimo dydį, galime teigti, kad D reikšmė šiuo atveju yra santykinai maža (D<Р). Это и понятно: лиганды F – и H 2 O находятся в левой части спектрохимического ряда и образуют слабое поле. Поэтому энергии расщепления D в данном случае недостаточно для спаривания электронов кобальта (III) и электронная конфигурация в этом случае - t 4 2g ,е 2 g , а не t 6 2g e 0 g .
Pavyzdys: naudodamiesi kristalų lauko teorija, paaiškinkite, kodėl kompleksinis jonas yra bespalvis vandeniniame tirpale, o 2 yra žalias?
Sprendimas : kompleksas - sudarytas iš vario katijono Cu + su elektronine konfigūracija 3d 10 4s 0, visos d-orbitalės užpildytos, elektronų pernešimas neįmanomas, todėl tirpalas nespalvotas. Kompleksą 2- sudaro Cu 2+ katijonas, kurio elektroninė konfigūracija yra 3d 9 4s 0, todėl d– polygyje yra laisva vieta. Elektronų perėjimas absorbuojant šviesą d-polygyje lemia komplekso spalvą. Vario (C) vandens kompleksai vandeniniame tirpale turi mėlyną spalvą; chlorido jonų įvedimas į vidinę komplekso sferą sukelia mišraus ligandų komplekso susidarymą, dėl kurio tirpalas pakeičia spalvą į žalią.
Pavyzdys: Naudodami valentinio ryšio metodą, atsižvelgdami į kristalų lauko teoriją, nustatykite centrinio atomo hibridizacijos tipą ir numatykite kompleksų geometrinę formą:
- + -
Sprendimas: Iš nurodytų kompleksų parinksime junginius, sudarytus iš E +, tai yra:
+ - 3-
- + .
Cheminė jungtis šiuose kompleksuose susidaro veikiant donoro-akceptoriaus mechanizmui, elektronų donorai yra ligandai: amoniako molekulės ir cianido jonai (monodantiniai ligandai) ir tiosulfato jonai (dvidentinis ligandas). Elektronų akceptorius yra E + katijonas. Elektroninė konfigūracija (n-1)d 10 ns 0 np 0 . Formuojantis dviem ryšiams su monodantiniais ligandais dalyvauja išorinės ns- ir np-orbitalės, centrinio atomo hibridizacijos tipas yra sp, geometrinė kompleksų forma linijinė, nėra neporinių elektronų, jonas yra diamagnetinis . Kai su dvišakiu ligandu susidaro keturi donoro-akceptoriaus ryšiai, MBC dalyvauja viena s-orbitalė ir trys centrinio atomo p-orbitalės, hibridizacijos tipas yra sp 3, komplekso geometrinė forma yra tetraedrinė, ten. nėra nesuporuotų elektronų.
Antroji kompleksų grupė:
- - - 3+
sudarytas iš aukso(III) jono, kurio elektroninė konfigūracija yra 5d 8 6s 0. Ligandai, dalyvaujantys formuojant kompleksus, pagal spektrocheminę ligandų seriją gali būti skirstomi į silpnuosius: chlorido ir bromido jonus ir stipriuosius: amoniako ir cianido jonus. Pagal Hundo taisyklę, 5d orbitose yra du nesuporuoti elektronai ir jie išlaikomi formuojantis donoro-akceptoriaus ryšiams su silpno lauko ligandais. Ryšiams sudaryti aukso katijonas suteikia vieną 6s ir tris 6p orbitales. Centrinio sp 3 atomo hibridizacijos tipas. Erdvinė kompleksinio jono struktūra yra tetraedrinė. Yra du nesuporuoti elektronai, kompleksas yra paramagnetinis.
Stipraus lauko ligandų įtakoje aukso (III) jono elektronai susiporuoja su vienos 5d orbitalės išleidimu. Viena centrinio atomo 5d-, viena 6s- ir dvi 6p-orbitalės dalyvauja formuojant keturis donoro-akceptoriaus ryšius. Hibridizacijos tipas dsp 2. Dėl to kompleksinio jono struktūra yra plokščia kvadratinė. Nėra nesuporuotų elektronų, kompleksai yra diamagnetiniai.
Komplekso tirpalo spalva priklauso nuo jo sudėties, struktūros ir yra nulemta bangos ilgio l max, atitinkančio sugerties juostos maksimumą, juostos intensyvumo, kuris priklauso nuo to, ar kvantinės cheminės medžiagos atitinkantis elektroninis perėjimas yra draudžiamas. , ir sugerties juostos susiliejimą, kuris priklauso nuo daugelio parametrų, tokių kaip komplekso elektroninė struktūra, šiluminio judėjimo intensyvumas sistemoje, koordinacinio daugiakampio taisyklingos geometrinės formos iškraipymo laipsnis ir kt.
Valentinės jungties metodo teorija
1s 2 2s 2 2p 6 3s 2 3p 6 4s 0 3d 6 4p 0 4d 0
Pagal Hundo taisyklė elektronai išoriniame energijos lygyje yra išsidėstę taip:
Kompleksuojantis agentas turi koordinacinį numerį c.n. = 6, todėl jis gali prijungti 6 ligandus, kurių kiekvienas turi po vieną elektronų porą ir todėl yra elektronų donoras. Akceptorius (kompleksuojantis agentas) turi sudaryti šešias laisvas orbitales, kad tilptų šešios elektronų poros. Susidarius kompleksiniam 3+ jonui, keturi nesuporuoti elektronai d – Co 3+ būsenoje pirmiausia sudaro elektronų poras, dėl kurių išsiskiria dvi 3d orbitalės:

Tada susidaro kompleksinis jonas 3+, kurio struktūra yra tokia:

Šio kompleksinio jono formavime dalyvauja vidinės 3d orbitalės ir išorinės 4s bei 4p orbitalės. hibridizacijos tipas - d 2 sp 3 .
Tik suporuotų elektronų buvimas rodo jonų diamagnetines savybes.
Kristalų lauko teorija
Kristalų lauko teorija yra pagrįstas prielaida, kad ryšys tarp kompleksą sudarančio agento ir ligandų yra dalinis. Tačiau atsižvelgiama į ligandų elektrostatinio lauko įtaką centrinio jono elektronų energetinei būklei.
Panagrinėkime dvi kompleksines druskas: K 2 ir K 3 .
K 2 – turi tetraedrinę erdvinę struktūrą ( sp 3 - hibridizacija)
K 3 – turi oktaedrinę erdvinę struktūrą ( sp 3 d 2 - hibridizacija)
Kompleksinės medžiagos turi šias savybes elektroninė konfigūracija:
d – vienodo energijos lygio elektronai yra vienodi laisvo atomo ar jono atveju. Tačiau ligandų elektrostatinio lauko veikimas prisideda prie d-orbitalių energijos lygių padalijimo centriniame jone. Ir kuo stipresnis ligandų sukuriamas laukas, tuo didesnis skilimas (tam pačiam kompleksuojančiam agentui). Pagal gebėjimą suskaidyti energijos lygius ligandai yra išdėstyti iš eilės:
CN — > NO 2 — > NH 3 > SCN — > H 2 O > OH — > F — > Cl — > Br — > I —
Komplekso jonų struktūra turi įtakos kompleksą sudarončio agento energijos lygių padalijimo pobūdžiui.
At oktaedrinė struktūra kompleksinis jonas, d γ -orbitalės (d z 2 -, d x 2 - y 2 -orbitalės) priklauso nuo stipri ligandų lauko sąveika, o šių orbitalių elektronai gali turėti didesnę energiją nei d ε -orbitalių elektronai (d xy, d xz, d yz - orbitalės).
Elektronų energijos lygių padalijimas d-būsenoje ligandų oktaedriniame lauke gali būti pavaizduotas diagramos forma:

Čia Δ oct yra skilimo energija oktaedriniame ligandų lauke.
Su tetraedrine struktūra Sudėtingo jono d γ orbitalės turi mažesnę energiją nei d ε orbitalės:

Čia Δ tetr yra skilimo energija tetraedriniame ligandų lauke.
Skaldymo energija Δ eksperimentiniu būdu iš šviesos kvantų sugerties spektrų nustatoma medžiaga, kurios energija lygi atitinkamų elektroninių perėjimų energijai. Absorbcijos spektras, taip pat sudėtingų d elementų junginių spalva atsiranda dėl elektronų perėjimo iš mažesnės energijos d-orbitalės į didesnės energijos d-orbitalę.
Taigi, K 3 druskos atveju, absorbuojant šviesos kvantą, tikėtinas elektronų perėjimas iš d ε orbitos į d γ orbitą. Tai paaiškina, kad ši druska yra oranžinės raudonos spalvos. O K2 druska negali sugerti šviesos ir dėl to yra bespalvė. Tai paaiškinama tuo, kad elektronų perėjimas iš d γ orbitos į d ε orbitą neįmanomas.
Molekulinės orbitos teorija
MO metodas skyriuje buvo aptarta anksčiau.
Naudodami šį metodą pavaizduosime didelio sukimosi kompleksinio jono 2+ elektroninę konfigūraciją.
Elektroninė Ni 2+ jonų konfigūracija:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 0 3d 8 4p 0 4d 0 arba …4s 0 3d 8 4p 0 4d 0

Sudėtingame jone 2+ dalyvauti formuojant cheminius ryšius 8 elektronai centrinis Ni 2+ jonas ir 12 elektronų šešių NH 3 ligandų.
Sudėtingas jonas Tai turi oktaedrinė struktūra. MO susidarymas įmanomas tik tada, kai pradinių sąveikaujančių dalelių energijos yra artimos savo vertėms ir atitinkamai yra orientuotos erdvėje.
Mūsų atveju Ni 2+ jono 4s orbitalė vienodai sutampa su kiekvieno iš šešių ligandų orbitomis. Dėl to susidaro molekulinės orbitalės: jungiantis σ s b ir antirišantis σ s dis.
Komplekso agento trijų 4p orbitalių sutapimas su ligandų orbitalėmis susidaro šešios σp-orbitalės: surišimas σ x, σ y, σ z ir antijungimas σ x, σ y, σ z.
Sutampantis d z 2 ir d x 2 - y 2 komplekso formuotojas su ligandų orbitomis prisideda prie keturių molekulinių orbitalių susidarymo: dviejų jungiamųjų σ jungties x 2 - y 2, σ jungties z 2 ir dviejų antijunginių σ pertraukos x 2 - y 2, σ pjūvio z 2.
Ni 2+ jono orbitalės d xy , d xz , d yz prie ligandų orbitalių nesijungia, nes nėra nukreipti į juos. Dėl to jie nedalyvauja formuojant σ ryšį ir yra nesurišančios orbitos: π xz, π xy, π yz.
Iš viso kompleksinis 2+ jonas turi 15 molekulinių orbitų. Elektronų išsidėstymą galima pavaizduoti taip:
(σ s св) 2 (σ х св) 2 (σ y св) 2 (σ z св) 2 (σ св x 2 - y 2) 2 (σ св z 2) 2 (π xz) 2 (π xy) 2 (π yz) 2 (σ dydis x 2 – y 2) (σ dydis z 2)
Molekulinių orbitalių susidarymas schematiškai parodytas toliau pateiktoje diagramoje:

Pažvelkime į užduotį Nr.1 iš Vieningo valstybinio egzamino variantų 2016 m.
Užduotis Nr.1.
Išorinio elektronų sluoksnio 3s²3p6 elektroninė formulė atitinka kiekvienos iš dviejų dalelių struktūrą:
1. Arº ir Kº 2. Cl‾ ir K+ 3. S²‾ ir Naº 4. Clº ir Ca2+
Paaiškinimas: tarp atsakymų variantų yra nesužadintos ir sužadintos būsenos atomai, tai yra, tarkime, kalio jono elektroninė konfigūracija neatitinka jo padėties periodinėje lentelėje. Apsvarstykime 1 variantą Arº ir Kº. Parašykime jų elektronines konfigūracijas: Arº: 1s2 2s2 2p6 3s2 3p6; Kº: 1s2 2s2 2p6 3s2 3p6 4s1 – tinkama elektroninė konfigūracija tik argonui. Apsvarstykime atsakymo variantą Nr. 2 – Cl‾ ir K+. K+: 1s2 2s2 2p6 3s2 4s0; Cl‾: 1s2 2s2 2p6 3s2 3p6. Vadinasi, teisingas atsakymas yra 2.
2 užduotis.
1. Caº 2. K+ 3. Cl+ 4. Zn2+
Paaiškinimas: nes rašome elektroninę argono konfigūraciją: 1s2 2s2 2p6 3s2 3p6. Kalcis netinka, nes turi dar 2 elektronus. Kaliui: 1s2 2s2 2p6 3s2 3p6 4s0. Teisingas atsakymas yra 2.
Užduotis Nr.3.
Elementas, kurio atominė elektroninė konfigūracija yra 1s2 2s2 2p6 3s2 3p4, sudaro vandenilio junginį
1. CH4 2. SiH4 3. H2O 4. H2S
Paaiškinimas: Pažiūrėkime į periodinę lentelę, sieros atomas turi tokią elektroninę konfigūraciją. Teisingas atsakymas yra 4.
4 užduotis.
Magnio atomai ir
1. Kalcis 2. Chromas 3. Silicis 4. Aliuminis
Paaiškinimas: Magnis turi išorinę energijos lygio konfigūraciją: 3s2. Kalciui: 4s2, chromui: 4s2 3d4, siliciui: 3s2 2p2, aliuminiui: 3s2 3p1. Teisingas atsakymas yra 1.
Užduotis Nr.5.
Argono atomas pagrindinėje būsenoje atitinka dalelės elektronų konfigūraciją:
1. S²‾ 2. Zn2+ 3. Si4+ 4. Seº
Paaiškinimas: Elektroninė argono konfigūracija pagrindinėje būsenoje yra 1s2 2s2 2p6 3s2 3p6. S²‾ turi elektroninę konfigūraciją: 1s2 2s2 2p6 3s2 3p(4+2). Teisingas atsakymas yra 1.
6 užduotis.
Fosforo ir fosforo atomai turi panašią išorinio energijos lygio konfigūraciją.
1. Ar 2. Al 3. Cl 4. N
Paaiškinimas: Parašykime fosforo atomo išorinio lygio elektroninę konfigūraciją: 3s2 3p3.
Aliuminiui: 3s2 3p1;
Argonui: 3s2 3p6;
Chlorui: 3s2 3p5;
Azotui: 2s2 2p3.
Teisingas atsakymas yra 4.
Užduotis Nr.7.
Elektronų konfigūracija 1s2 2s2 2p6 3s2 3p6 atitinka dalelę
1. S4+ 2. P3- 3. Al3+ 4. O2-
Paaiškinimas:ši elektroninė konfigūracija atitinka pagrindinės būsenos argono atomą. Panagrinėkime atsakymų variantus:
S4+: 1s2 2s2 2p6 3s2 2p0
P3-: 1s2 2s2 2p6 3s2 3p (3+3)
Teisingas atsakymas yra 2.
8 užduotis.
Kuri elektroninė konfigūracija atitinka valentinių elektronų pasiskirstymą chromo atome:
1. 3d2 4s2 2. 3s2 3p4 3. 3d5 4s1 4. 4s2 4p6
Paaiškinimas: Parašykime elektroninę chromo konfigūraciją pagrindinėje būsenoje: 1s2 2s2 2p6 3s2 3p6 4s1 3d5. Valentiniai elektronai yra paskutiniuose dviejuose polygiuose 4s ir 3d (čia vienas elektronas peršoka iš s į d polygį). Teisingas atsakymas yra 3.
Užduotis Nr.9.
Atomas turi tris nesuporuotus elektronus išoriniame elektroniniame lygyje pagrindinėje būsenoje.
1. Titanas 2. Silicis 3. Magnis 4. Fosforas
Paaiškinimas: Norint turėti 3 nesuporuotus elektronus, elementas turi būti 5 grupėje. Vadinasi, teisingas atsakymas yra 4.
10 užduotis.
Cheminio elemento, kurio didžiausias oksidas yra RO2, atomas turi išorinio lygio konfigūraciją:
1. ns2 np4 2. ns2 np2 3. ns2 4. ns2 np1
Paaiškinimas:šio elemento oksidacijos būsena (šiame junginyje) yra +4, tai yra, išoriniame lygyje turi būti 4 valentiniai elektronai. Vadinasi, teisingas atsakymas yra 2.
(galite manyti, kad teisingas atsakymas yra 1, bet tokio atomo maksimali oksidacijos būsena būtų +6 (kadangi išoriniame lygyje yra 6 elektronai), bet mums reikia aukštesnio oksido, kad būtų formulė RO2 ir pan. elementas turėtų didesnį oksidą RO3)
Savarankiško darbo užduotys.
1. Elektroninė konfigūracija 1s2 2s2 2p6 3s2 3p5 atitinka atomą
1. Aliuminis 2. Azotas 3. Chloras 4. Fluoras
2. Dalelė turi aštuonių elektronų išorinį apvalkalą
1. P3+ 2. Mg2+ 3. Cl5+ 4. Fe2+
3. Elemento, kurio atominė elektroninė struktūra yra 1s2 2s2 2p3, atominis skaičius yra lygus
1. 5 2. 6 3. 7 4. 4
4. Elektronų skaičius vario jone Cu2+ yra
1. 64 2. 66 3. 29 4. 27
5. Azoto atomai ir
1. Siera 2. Chloras 3. Arsenas 4. Manganas
6. Kuriame junginyje yra katijonas ir anijonas, kurių elektronų konfigūracija yra 1s2 2s2 2p6 3s3 3p6?
1. NaCl 2. NaBr 3. KCl 4. KBr
7. Elektronų skaičius geležies jone Fe2+ yra
1. 54 2. 28 3. 58 4. 24
8. Jonas turi inertinių dujų elektroninę konfigūraciją
1. Cr2+ 2. S2- 3. Zn2+ 4. N2-
9. Fluoro ir fluoro atomai turi panašią išorinio energijos lygio konfigūraciją
1. Deguonis 2. Litis 3. Bromas 4. Neonas
10. Elementas, kurio atominė elektroninė formulė yra 1s2 2s2 2p6 3s2 3p4, atitinka vandenilio junginį
1. HCl 2. PH3 3. H2S 4. SiH4
Šioje pastaboje naudojamos užduotys iš 2016 m. vieningo valstybinio egzamino rinkinio, kurį redagavo A.A. Kaverina.
Norėdami paleisti šią programą, turite įjungti „JavaScript“.Elektroninė atomo konfigūracija yra formulė, rodanti elektronų išsidėstymą atome pagal lygius ir polygius. Išstudijavę straipsnį, sužinosite, kur ir kaip yra elektronai, susipažinsite su kvantiniais skaičiais ir pagal jo skaičių galėsite sukonstruoti elektroninę atomo konfigūraciją, straipsnio pabaigoje yra elementų lentelė.
Kodėl verta studijuoti elektroninę elementų konfigūraciją?
Atomai yra kaip konstrukcinis rinkinys: yra tam tikras skaičius dalių, jos skiriasi viena nuo kitos, tačiau dvi to paties tipo dalys yra visiškai vienodos. Tačiau šis konstrukcinis rinkinys yra daug įdomesnis nei plastikinis ir štai kodėl. Konfigūracija keičiasi priklausomai nuo to, kas yra šalia. Pavyzdžiui, deguonis šalia vandenilio Gal būt virsta vandeniu, kai prie natrio virsta dujomis, o kai prie geležies visiškai paverčia rūdimis. Norint atsakyti į klausimą, kodėl taip atsitinka, ir numatyti atomo elgesį šalia kito, būtina ištirti elektroninę konfigūraciją, kuri bus aptarta toliau.
Kiek elektronų yra atome?
Atomas susideda iš branduolio ir aplink jį besisukančių elektronų, o branduolį sudaro protonai ir neutronai. Neutralioje būsenoje kiekvienas atomas turi elektronų skaičių, lygų protonų skaičiui jo branduolyje. Protonų skaičius žymimas elemento atominiu numeriu, pavyzdžiui, siera turi 16 protonų - 16-asis periodinės lentelės elementas. Auksas turi 79 protonus – 79-ąjį periodinės lentelės elementą. Atitinkamai, siera neutralioje būsenoje turi 16 elektronų, o auksas – 79 elektronus.
Kur ieškoti elektrono?
Stebint elektrono elgesį, buvo išvesti tam tikri modeliai, jie apibūdinami kvantiniais skaičiais, iš viso yra keturi:
- Pagrindinis kvantinis skaičius
- Orbitinis kvantinis skaičius
- Magnetinis kvantinis skaičius
- Sukimosi kvantinis skaičius
Orbitinė
Be to, vietoj žodžio orbita vartosime terminą „orbita“; orbita yra elektrono banginė funkcija; apytiksliai tai yra sritis, kurioje elektronas praleidžia 90% savo laiko.
N – lygis
L - apvalkalas
M l – orbitos skaičius
M s – pirmasis arba antrasis elektronas orbitoje
Orbitinis kvantinis skaičius l
Ištyrę elektronų debesį, jie nustatė, kad priklausomai nuo energijos lygio debesis yra keturių pagrindinių formų: rutulio, hantelių ir dviejų kitų sudėtingesnių. Energijos didėjimo tvarka šios formos vadinamos s-, p-, d- ir f-apvalkalais. Kiekvienas iš šių apvalkalų gali turėti 1 (ant s), 3 (ant p), 5 (ant d) ir 7 (ant f) orbitales. Orbitos kvantinis skaičius yra apvalkalas, kuriame yra orbitos. Orbitalių s, p, d ir f orbitų kvantinis skaičius yra atitinkamai 0, 1, 2 arba 3.
Ant s apvalkalo yra viena orbitalė (L=0) – du elektronai
Ant p apvalkalo (L=1) yra trys orbitos – šeši elektronai
Ant d apvalkalo (L=2) yra penkios orbitos – dešimt elektronų
Ant f apvalkalo yra septynios orbitos (L=3) – keturiolika elektronų
Magnetinis kvantinis skaičius m l
Ant p apvalkalo yra trys orbitos, jos žymimos skaičiais nuo -L iki +L, tai yra, p apvalkalui (L=1) yra orbitos „-1“, „0“ ir „1“. . Magnetinis kvantinis skaičius žymimas raide m l.
Korpuso viduje elektronams lengviau išsidėstyti skirtingose orbitalėse, todėl pirmieji elektronai užpildo po vieną kiekvienoje orbitoje, o vėliau prie kiekvienos pridedama elektronų pora.
Apsvarstykite d-shell:
D-apvalkalas atitinka reikšmę L=2, tai yra penkios orbitalės (-2,-1,0,1 ir 2), pirmieji penki elektronai užpildo apvalkalą, gaudami reikšmes M l =-2, M l =-1, Ml =0, Ml =1, Ml =2.
Sukimosi kvantinis skaičius m s
Sukas yra elektrono sukimosi aplink savo ašį kryptis, yra dvi kryptys, todėl sukimosi kvantinis skaičius turi dvi reikšmes: +1/2 ir -1/2. Viename energijos polygyje gali būti tik du elektronai su priešingais sukiniais. Sukimosi kvantinis skaičius žymimas m s
Pagrindinis kvantinis skaičius n
Pagrindinis kvantinis skaičius yra energijos lygis, šiuo metu žinomi septyni energijos lygiai, kurių kiekvienas žymimas arabišku skaitmeniu: 1,2,3,...7. Apvalkalų skaičius kiekviename lygyje yra lygus lygio skaičiui: pirmame lygyje yra vienas apvalkalas, antrame – du ir t.t.
Elektronų skaičius

Taigi, bet kurį elektroną galima apibūdinti keturiais kvantiniais skaičiais, šių skaičių derinys yra unikalus kiekvienai elektrono pozicijai, paimkite pirmąjį elektroną, žemiausias energijos lygis yra N = 1, pirmame lygyje yra vienas apvalkalas, pirmasis apvalkalas bet kuriame lygyje turi rutulio formą (s -shell), t.y. L=0, magnetinis kvantinis skaičius gali turėti tik vieną reikšmę, M l =0 ir sukinys bus lygus +1/2. Jei imsime penktąjį elektroną (kad ir kokiame atome jis būtų), tai pagrindiniai jo kvantiniai skaičiai bus: N=2, L=1, M=-1, sukinys 1/2.